Substancje chemiczne
Pojęcie pierwiastka i związku chemicznego
Substancja (chemiczna)
Substancja (chemiczna), to zbiór atomów lub cząsteczek spełniających kryterium stałości składu.Substancje chemiczne dzielimy na:
- proste - formy występowania w stanie wolnym pierwiastków chemicznych
- złożone - związki chemiczne
Do substancji chemicznych nie zaliczamy mieszanin zarówno jednorodnych, jak i niejednorodnych. Nazywamy je preparatami chemicznymi.
Pierwiastek
Pierwiastek, to zbiór atomów posiadających tą samą liczbę atomową, która określa ile protonów znajduje się w jądrze danego atomu.Związek chemiczny
Związek chemiczny tworzy zbiór cząsteczek, które mogą być zbudowane z dwóch lub więcej rodzajów atomów. Związek chemiczny charakteryzuje się stałym składem chemicznym i stałymi właściwościami.Alotropia
Alotropia jest to występowanie tych samych pierwiastków chemicznych w różnych postaciach, które różnią się od siebie właściwościami. Różnica właściwości może być spowodowana różną budową krystaliczną (diament a grafit), rożną liczbą atomów w cząsteczce (tlen a ozon)Symbole i wzory chemiczne
Symbol pierwiastka
Każdy pierwiastek posiada swój określony symbol, na przykład węgiel ma symbol C. Symbol pierwiastka pochodzi od jego nazwy łacińskiej. Pierwiastki nowo odkrywane, te o najwyższych liczbach atomowych mają symbole trzyliterowe.Wzór sumaryczny
Wzór sumaryczny jest sposobem zapisu, który określa rodzaj i liczbę tomów związku chemicznegoWzór strukturalny
Wzór strukturalny opisuje rodzaj i liczbę atomów w cząsteczce oraz rodzaj wzajemnego powiązania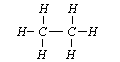
Wzór strukturalny uproszczony
Wzór strukturalny uproszczony stosowany jest w celu uproszczenia zapisu cząsteczek związków organicznych, pomija się w nim wiązania łączące dany pierwiastek z atomami wodoru.Wzór elektronowy(wzór Lewisa)
Wzór elektronowy(wzór Lewisa) to taki wzór, w którym przedstawia się wszystkie elektrony walencyjne atomów występujących w danej cząsteczce.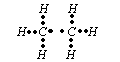
Wzór elementarny (empiryczny)
Wzór elementarny (empiryczny) jest to najprostsza postać zapisu związku, która podaje, w jakim stosunku ilościowym występują atomy pierwiastków w danej cząsteczce.
Wartościowość pierwiastków
Wartościowość pierwiastków, to cecha pierwiastków chemicznych określająca iloma wiązaniami chemicznymi może się dany pierwiastek łączyć z innymi. Pojęcie to, jest często zastępowane pojęciem stopnia utlenienia i liczby koordynacyjnej, wynika to z faktu małej precyzyjności tego pojęcia, które uwypukla się przy opisie wiązań lub oddziaływań będących na granicy wiązań i innych oddziaływań fizycznych.Należy pamiętać, że większość pierwiastków może przyjmować różną wartościowość w różnych związkach chemicznych. Wartościowość przyjęto oznaczać liczbą rzymską (I, II, III, IV…)
Zasady tworzenia wzoru sumarycznego
Przy tworzeniu wzoru sumarycznego związku najwygodniej jest posłużyć się metodą krzyżowej wartościowości. Zapisujemy ogólną postać związku z uwzględnieniem wartościowości pierwiastków. Ilość atomów poszczególnych pierwiastków oznaczamy jako niewiadome (na przykład: x,y,z…).Niewiadomym pierwiastka A przypisujemy wartościowość pierwiastka B, niewiadomym pierwiastka B przypisujemy wartościowość pierwiastka A (na krzyż):
Jeżeli liczby przypisane niewiadomym mają wspólny podzielnik to je skracamy.
a) związek: wodór (H) i tlen(O):
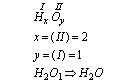
b) związek: siarka(S) i tlen(O):
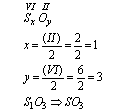
Regule krzyżowej wartościowości nie podlegają dwa typy związków:
a) związki, w których występują wiązania chemiczne miedzy atomami tego samego pierwiastka na przykład:
nadtlenki
węglowodory
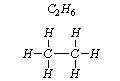
b) związki, które zawierają atomy tego samego pierwiastka lecz o różnej wartościowości, na przykład
Tę regułę możemy też zastosować do związków zawierających więcej niż dwa pierwiastki, jeżeli fragment (A) tego związku lub fragment (B) ewentualnie oba te fragmenty są grupami
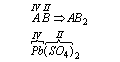
Stopień utlenienia, zasady określania stopnia utlenienia
Stopień utlenienia odpowiada liczbie ładunków elementarnych (elektronów), które miałby dany atom, gdyby wszystkie wiązania w danej substancji były jonowe (jeżeli przekazanie elektronu oznacza pełne przekazanie elektronu to powstaje wiązanie jonowe, gdy przekazanie elektronu jest częściowe to tworzy się wiązanie kowalencyjne).Stopień utlenienia pierwiastka w danym związku chemicznym podaje się za pomocą cyfr rzymskich, zapisywanej nad symbolem pierwiastka, jeżeli stopień utlenienia jest ujemny to cyfrę rzymska poprzedza się znakiem minus.
Przykład zapisu
Stopień utlenienia pierwiastka wpływa na jego właściwości chemiczne. Jeżeli wzrasta stopień utlenienia to:
- właściwości zmieniają się od zasadowych przez amfoteryczne do kwasowych
- wzrasta tendencja do tworzenia anionów, maleje do tworzenia kationów
- rośnie moc kwasów tlenowych, maleje moc wodorotlenków
- rosną właściwości utleniające, maleją właściwości redukujące
Jak określić stopień utlenienia pierwiastka?
- stopień utlenienia pierwiastków w stanie wolnym wynosi zero;
- suma stopni utlenienia w obojętnej cząsteczce wynosi zero, jeżeli jest to jon złożony, to równy jest ładunkowi tego jonu
- w jonie jednoatomowym stopień utlenienia pierwiastka jest równy ładunkowi tego jonu
- tlen w związkach ma stopień utlenienia (-II) za wyjątkiem związków, w których występuje wiązanie miedzy dwoma atomami tlenu oraz w związkach z fluorem
- wodór w związkach ma stopień utlenienia (I) za wyjątkiem wodorków metali oraz w związkach z pierwiastkami mniej od niego elektroujemnymi, wtedy stopień utlenienia wodoru wynosi (-I)
- fluor w związkach ma zawsze stopień utlenienia(-I)
- litowce w związkach zawsze mają stopień utlenienia (I)
- berylowce w związkach mają zawsze stopień utlenienia (II)
- chlor w związkach ma stopień utlenienia (-I) za wyjątkiem związków z fluorem i tlenem
Mieszaniny substancji
Podział mieszanin:- homogeniczne- są jednorodne fizycznie, nie można w nich gołym okiem lub prostymi przyrządami optycznymi rozróżnić składników
- heterogeniczne- są niejednorodne fizycznie, składnik tych mieszanin są widoczne
Rozdzielanie mieszanin niejednorodnych
- sedymentacja- jest to proces zachodzący samorzutnie w wyniku różnicy gęstości składników mieszaniny
- dekantacja- zlewanie cieczy znad osadu
- sączenie (filtrowanie)- zlewanie mieszaniny przez filtr, który zatrzymuje substancje stałe
- odparowanie- ogrzewanie mieszaniny, w wyniku którego odparowuje bardziej lotny składnik
- krystalizacja- polega na wykorzystaniu różnic w rozpuszczalności składników mieszaniny w zależności od temperatury
- destylacja- polega na wykorzystaniu różnic w temperaturach wrzenia składników mieszaniny
- chromatografia- rozdział substancji następuje w wyniku przepuszczenia roztworu badanej mieszaniny przez specjalnie spreparowaną fazę rozdzielczą (złoże). Fazą rozdzielczą są substancje wykazujące zdolności sorpcyjne lub zdolne do innych oddziaływań na substancje przepływające. Podczas przepływu eluenta (fazy ruchomej) przez fazę rozdzielczą następuje proces wymywania zaadsorbowanych (lub związanych) substancji. Intensywność tego procesu jest różna dla poszczególnych składników mieszaniny. Jedne składniki są więc zatrzymywane w fazie dłużej, a inne krócej, dzięki czemu może następować ich oddzielenie.
Mieszanina a związek chemiczny- różnice
- związek chemiczny powstaje w wyniku reakcji chemiczne, mieszaninę otrzymujemy metodami fizycznymi
- związek chemiczny ma określony niezmienny skład, mieszaninami skład dowolny
- związek chemiczny ma inne właściwości niż pierwiastki, które go tworzą, składniki mieszanin zachowują swoje właściwości
- związek chemiczny można rozłożyć tylko reakcja chemiczną, mieszaninę można rozdzielić wykorzystując właściwości fizyczne jej składników




