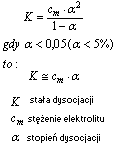Elektrolity mocne i słabe
Elektrolity mocne
Elektrolity mocne prawie całkowicie dysocjują, stąd bardzo dobrze przewodzą prąd elektryczny. Do elektrolitów mocnych należą:a) wszystkie sole
b) wodorotlenki litowców i wapniowców oprócz
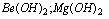
c) niektóre kwasy
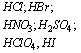
Elektrolity słabe
Elektrolity słabe dysocjują częściowo, stąd dużo gorzej przewodzą prąd elektryczny niż elektrolity mocne. W roztworach słabych elektrolitów ustala się stan równowagi chemicznej miedzy niezdysocjowanymi cząsteczkami a powstającymi jonami, np.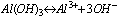
Do słabych elektrolitów należą pozostałe kwasy i zasady nie wymienione w grupie powyżej (elektrolity mocne), wszystkie kwasy organiczne.
Stopień dysocjacji
Stopień dysocjacji określa moc elektrolitu, jego wartość odpowiada stosunkowi liczby moli cząsteczek dysocjowanych na jony do całkowitej liczby moli cząsteczek wprowadzonych do roztworu
Stopień dysocjacji zależy od:
a) rodzaju elektrolitu, elektrolity mocne posiadają stopień dysocjacji powyżej 30%
b) temperatury, stopień dysocjacji rośnie ze wzrostem temperatury
c) jest odwrotnie proporcjonalne do stężenia elektrolitu (gdy stężenie roztworu maleje, to rośnie stopień dysocjacji rośnie)
d) obecności innych substancji w roztworze
Stała dysocjacji (K)
Stała dysocjacji (K)- jest to stała równowagi chemicznej procesu dysocjacji, jest to wielkość charakterystyczna dla danego elektrolitu, nie zależy od stężenia, a jedynie od temperatury (rośnie z jej wzrostem)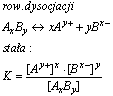
Dysocjacja etapowa
Dysocjacja etapowa (stopniowa)- jest to dysocjacja zachodząca w dwóch lub więcej etapach, każdy z etapów ma inną wydajność, najczęściej coraz to niższą. Przykładowo kwas siarkowy dysocjuje w dwóch etapach. W etapie pierwszym jest mocnym elektrolitem, a w etapie drugim jest słabym elektrolitem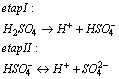
Prawo rozcieńczeń Ostwalda
Prawo rozcieńczeń Ostwalda to przybliżona zależność stopnia dysocjacji słabego elektrolitu od jego stężenia