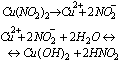Reakcje jonów
Reakcje zobojętnienia
Reakcje zobojętnienia, to reakcje jonów H(+) z jonami OH(-). Wynikiem tych reakcji jest powstawanie wody, a to oznacza, że reakcje zobojętnienia to reakcje mocnych kwasów z zasadami, na przykład: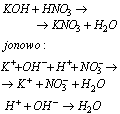
Reakcje strącania osadów
Produktem reakcje strącania osadów są związki bardzo trudno rozpuszczalne w wodzie, na przykład: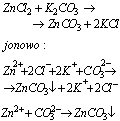
Reakcje metali z kwasami
Reakcje metali z kwasami przebiegają z wydzieleniem wodoru, polegają one na reakcji jonów H(+) z atomami metalu, na przykład: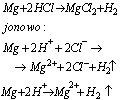
Reakcje wypierania słabych kwasów przez kwasy mocniejsze
Reakcje wypierania słabych kwasów przez kwasy mocniejsze prowadza do otrzymania słabych elektrolitów lub wydzielania się gazów, na przykład: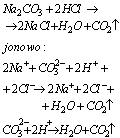
Reakcje wypieranie metali słabiej reaktywnych przez metale bardziej reaktywne
Reakcje wypieranie metali słabiej reaktywnych przez metale bardziej reaktywne zachodzą miedzy jonami tych metali, na przykład: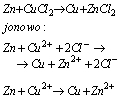
Reakcje hydrolizy soli
Hydroliza soli
- reakcja jonów niektórych soli z jonami wody, rezultatem hydrolizy jest kwaśny lub zasadowy odczyn roztworu.Sole mocnych zasad i słabych kwasów
ulegają w roztworze wodnym hydrolizie anionowej, reakcja przebiega według schematu: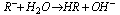
Odczyn wodnego roztworu takiej soli jest zasadowy. Na przykład hydroliza anionowa słabego kwasu i silnej zasady:
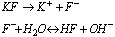
Sole słabych zasad i mocnych kwasów
Sole słabych zasad i mocnych kwasów ulegają w roztworze wodnym hydroliza anionowa, reakcja przebiega według schematu: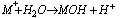
Odczyn wodnego roztworu takiej soli jest kwasowy. Na przykład hydroliza kationowa mocnego kwasu i słabej zasady:
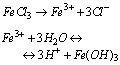
Sole mocnych zasad i mocnych kwasów
Sole mocnych zasad i mocnych kwasów nie ulegają hydrolizie, odczyn wodnego roztworu jest obojętny.Sole słabego kwasu i słabej zasady
Sole słabego kwasu i słabej zasady ulegają dwóm reakcjom hydrolizy: hydrolizie kationowej i hydrolizie anionowej. O odczynie roztworu decyduje różnica mocy tych słabych elektrolitów, czyli w zależności od tego, który z tych produktów reakcji jest lepiej dysocjowany. Ustala się ja na podstawie stałych dysocjacji.Przykład hydrolizy kationowo- anionowej: