Wodorki
Klasyfikacja związków nieorganicznych
Związki nieorganiczne dzielimy na:-tlenki
-wodorki
-wodorotlenki
-kwasy
-sole
Budowa wodorków
Wodorki są związkami chemicznymi dowolnego pierwiastka z wodorem. W zależności od grupy przynależności pierwiastka w układzie okresowym wzór wodorku przedstawia się:a) pierwiastek(E) należy do grup od 1 do 15:
wzór: EHn
przykład: CH4
b) pierwiastek(E) należy do grup 16 i 17:
wzór: HnE
przykład: H2S
Nazewnictwo wodorków
a) wodorek typu (EHn)jeżeli wodorek zapisywany jest według wzoru
EHn
to jego nazwę, tworzy się analogicznie do nazw tlenków, na przykład: NaH wodorek sodu
b) wodorek typu(HnE)
nazwy wodorków zapisywanych według wzoru
HnE
to jego nazwę, tworzy się przez połączenie nazwy pierwiastka literą "o" (interfiks) z wyrazem wodór.
Na przykład HCl to: chlor + o + wodór = chlorowodór
Otrzymywanie wodorków
Znaczną część wodorków otrzymuje się przez syntezę pierwiastka z wodorem. Podczas tych reakcji jedynie reakcja wodoru z fluorem zachodzi samorzutnie dając związek (HF). Podczas syntezy innych wodorków wymagana jest obecność światła (HCl), płomienia, który zapoczątkuje reakcję (na przykład H2O) lub katalizatora.Reakcje wodoru i metali wymagają dostarczenia dużej energii z zewnątrz, najczęściej w postaci dużego ciśnienia lub temperatury.
Właściwości fizyczne wodorków
Wodorek utworzony w reakcji: wodór + metal tworzy substancję stałą.W przypadku reakcji wodór + niemetal tworzy substancje najczęściej w stanie gazowym.
Większość wodorków metali podczas ogrzewania ulega rozkładowi na metal i wodór, zanim osiągną temperaturę topnienia.
Właściwości chemiczne wodorków
Właściwości chemiczne wodorków są bardzo różnorodne, jedną z najważniejszych cech jest zachowanie się wodorku w reakcji z wodą.Wodorki metali i reakcje z wodą
Wodorki metali reagują z wodą, produktami tych reakcji jest wodorotlenek i wodór. Przykładem reakcji może być: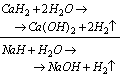
Oddziaływanie wodorków z wodą
Oddziaływanie wodorków z wodą może odbywać się na trzy sposoby:a) bez efektu chemicznego, czego przykładem jest metan CH4,który z wodą nie reaguje;
b) reakcja z wytworzeniem słabej zasady
c) wodorki fluorowców i siarkowców po rozpuszczeniu w wodzie ulegają dysocjacji jonowej, typowej dla kwasów, na przykład:
mocny elektrolit
słaby elektrolit
Wodorki metali
Wodorki metali wykazują charakter zasadowy- reagują z kwasami, na przykłada w reakcji z wodą, dają zasady
Wodorki niemetali
Wodorki niemetali wykazują różne właściwości. Przykładowo w roztworach wodnych, wodorki fluorowców wykazują odczyn kwasowy:Zaś amoniak w roztworze wodnym wykazuje odczyn słabo zasadowy:
Wodne roztwory
Wodne roztwory wodorków fluorowców i siarkowców tworzą kwasy beztlenowe, które są elektrolitami:-kwas bromowy HBr(aq)
-kwas chlorowodorowy (solny) HCl(aq)
-kwas fluorowodorowy HF(aq)
-kwas jodowodorowy HI(aq)
-kwas siarkowodorowy H2S(aq)
Trzy kwasy z wymienionych są bardzo mocnymi elektrolitami:
HCl(aq), HBr(aq), HI(aq)
Zastosowanie i występowanie wodorków
Najważniejszym wodorkiem występującym w przyrodzie jest woda. Jest ona zarówno tlenkiem wodoru oraz wodorkiem tlenu. Najczęściej występującymi wodorkami są: siarkowodór (występuje w złożach ropy naftowej i gazu ziemnego, spotykany również w niektórych wodach mineralnych); metan, który jest głównym składnikiem gazu ziemnego.W gospodarce przemysłowej wodorki są częstym produktem wytwarzanym w dużych ilościach. Do tej grupy należy chlorowodór i jego roztwór wodny- kwas solny, amoniak, który jest wykorzystywany przy produkcji nawozów sztucznych.
W gospodarce paliwowej największe zastosowanie z wodorków przypada metanowi (gaz ziemny).




