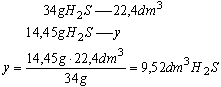44g siarczku żelaza(II) rozpuszczono w kwasie solnym i otrzymano siarkowodór z...
44g siarczku żelaza(II) rozpuszczono w kwasie solnym i otrzymano siarkowodór z wydajnością 85%. Obliczyć, ile dm3 siarkowodoru, odmierzonego w warunkach normalnych, otrzymano w tym doświadczeniu.
Rozwiązanie wybranego zadania z chemii
Wskazówka: Na podstawie równania reakcji obliczymy masy substancji:
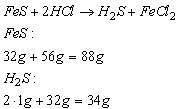
Na podstawie proporcji obliczymy ile siarkowodoru powstałoby, gdyby wydajność wynosiła 100%
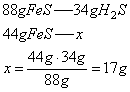
Wiemy, że wydajność reakcji wynosi 85%, stąd masa siarkowodoru powstałego w reakcji wynosi:
![]()
Masa jednego mola siarkowodoru wynosi 34g. W warunkach normalnych zajmuje on 22,4dm3. Ułożymy proporcję i obliczymy objętość wydzielonego siarkowodoru: