Elektrochemia. Elektroliza
Ogniwa chemiczne
Ogniwo chemiczne, to układ, w którym energia wewnętrzna substratów reakcji redoks (utleniania- redukcji) zmienia się w inny rodzaj energii. Ogniwo składa się, z co najmniej z trzech substancji stykających się w odpowiedniej kolejności: przewodnik metaliczny- przewodnik jonowy- przewodnik metaliczny. Przyczyna przepływu elektronów z anody do katody jest różnica potencjałów wewnętrznych faz metalicznych półogniw.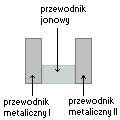
Przewodnik metaliczny
Przewodnik metaliczny, jest to materiał, który przewodzi prąd elektryczny za pośrednictwem elektronów.Przewodnik jonowy
Przewodnik jonowy, jest to materiał, który przewodzi prąd elektryczny za pośrednictwem jonów (kationy i aniony są nośnikiem ładunku elektrycznego)Ogniwa chemiczne dzielimy na nieregenerowalne oraz regenerowalne.
- Ogniwa nieregenerowalne, to ogniwa, które po wyczerpaniu się substratów reakcji utleniania- redukcji nie nadają się do ponownego ładowania (np. polarne baterie elektryczne)
- Ogniwa regenerowalne (akumulatory), to ogniwa, które po wyczerpaniu się substratów reakcji utleniania- redukcji można ponownie naładować, przeprowadzając elektrolizę, która jest procesem odwrotnym, wywołanym przez prąd elektryczny z zewnętrznego źródła prądu stałego, podłączonego odwrotnie biegunami elektrycznymi.
Elektroliza
Elektroliza, jest to reakcja przebiegająca na granicy faz przewodnik metaliczny, a przewodnik jonowy. Reakcja ta zachodzi podczas przepływu prądu elektrycznego przez układ trzech przewodników.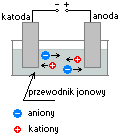
Podczas elektrolizy następuje ruch jonów w roztworze, kationy poruszają się w kierunku katody, a aniony do anody.
Katoda
Katda, to elektroda elektrolizera połączona z ujemnym biegunem źródła prądu stałego. Katoda podczas elektrolizy przyciąga do siebie jony dodatnie (kationy)Anoda
Anoda, to elektroda połączona z dodatnim biegunem źródła prądu elektrycznego. Anoda podczas elektrolizy przyciąga do siebie jony ujemne (aniony).W czasie elektrolizy na katodach zachodzą procesy połówkowe reakcji redoks. Na katodzie ma miejsce redukcja:
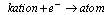
a na anodzie zachodzi utlenianie
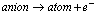
Półogniwa
Półogniwa, z których składają się ogniwa chemiczne, dzielą się na:a) półogniwa pierwszego rodzaju, w których to rozróżnia się:
- półogniwa odwracalne względem kationu (metal zanurzony w roztworze swoich jonów)
- półogniwa odwracalne względem anionu (platyna lub niemetal zanurzony w roztworze swoich jonów)
b) półogniwa drugiego rodzaju, są to elektrody wykonane z metalu, który jest pokryty trudnorozpuszczlną solą tego metalu lub jego trudnorozpuszczlnym wodorotlenkiem, elektroda jest zanurzona w roztworze zawierającym aniony tej soli lub tego wodorotlenku;
c) półogniwa redoks, są to elektrody wykonane z metalu szlachetnego, elektrody są zanurzone w roztworze zawierającym dwa rodzaje jonów tego samego pierwiastka, ale o róznych stopniach utleniania.
Siła elektromotoryczna ogniwa (SEM)
Siła elektromotoryczna ogniwa (SEM) jest równa różnicy potencjałów wewnętrznych między przewodnikami wykonanymi z tego samego metalu, dołączonymi do anody i katody, gdy przez ogniwo ni przepływa prąd elektryczny.SEM ogniwa zbudowanego z półogniw standardowych oblicza się z różnicy potencjałów standardowych katody (Ek) i anody(Ea).
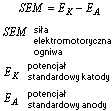
Zależność stosuje się dla ogniw, w których stężenie roztwory wynosi 1 mol/ dm3
Wzór Nernsta
Wzór Nernsta opisuje zależność elektrochemiczną wyrażającą równowagowy potencjału elektrody (E) względem jej potencjału standardowego (Eo) i stężenia substancji biorących udział w procesie elektrodowym
Prawa elektrolizy (prawa Faradaya)
I prawo
: masa substancji wydzielona na jednej z elektrod jest proporcjonalna do natężenia prądu przepływającego przez elektrolizer i czasu jego przepływu.
II prawo
: Stosunek mas (m1) oraz (m2) substancji wydzielonych na elektrodach podczas przepływu jednakowych ładunków elektrycznych jest równy stosunkowi ich równoważników elektrochemicznych (k1) oraz (k2) i stosunkowi ich mas równoważnikowych (R1) oraz (R2) czyli: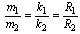
Ogniwo Daniela
Ogniwo Daniela, to ogniwo galwaniczne, w którym pierwsze półogniwo stanowi elektroda cynkowa zanurzona w roztworze siarczanu cynku ZnSO4, a drugie elektroda miedziana zanurzona w roztworze siarczanu miedzi CuSO4.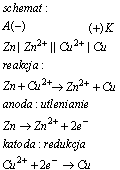
Ogniwo Volty
Ogniwo Volty, to ogniwo galwaniczne składające się płytek: cynkowej i miedzianej, które są zanurzone w roztworze wodnym kwasu siarkowego (VI).










