Reakcje chemiczne
Warunkiem zajścia reakcji chemicznej jest to, że drobiny substratów muszą mieć energię wystarczająca do tego, by wystąpiło tak zwane aktywne zderzenie drobin. Ta energia jest różna dla rożnych reakcji i nazywamy ją energią aktywacji.Prawo zachowania masy
Suma mas produktów otrzymanych w wyniku reakcji chemicznej jest równa sumie mas substratów biorących udział w tej reakcji (liczba atomów danego pierwiastka chemicznego podczas reakcji chemicznej nie zmienia się - łączna masa atomów w układzie reakcyjnym po reakcji jest taka sama jak przed jej zajściem)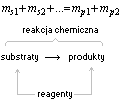
Efekt energetyczny reakcji chemicznej
Efekt energetyczny reakcji, jest to ilość energii przekazanej przez reagenty do otoczenia lub pobranej z otoczenia.Reakcja egzoenergetyczna
Reakcja egzoenergetyczna, podczas tej reakcji wydziela się energia, która jest przekazywana do otoczenia.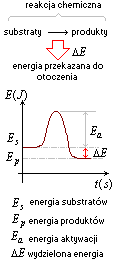
Reakcja endoenergetyczna
Reakcja endoenergetyczna, podczas tej reakcji energia pochłaniana jest z otoczenia przez reagenty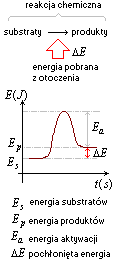
Entalpia reakcji
Entalpia reakcji chemicznej, jest to energia wymieniona sposobem cieplnym między reagentami a otoczeniem podczas reakcji przebiegającej pod stałym ciśnieniem, w której temperatura produktów jest taka sama jak temperatura początkowa substratów. Oznaczamy symbolem:
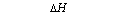
Entalpia reakcji jest mniejsza od zera dla reakcji egzotermicznej, ponieważ energia reagentów jest oddawana do otoczenia.
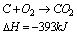
Entalpia reakcji jest większa od zera dla reakcji endotermicznej, ponieważ energia jest pobierana z otoczenia
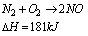
Katalizatory. Inhibitory.
Katalizator, to substancja, której obecność w mieszaninie reakcyjnej powoduje przyśpieszenie reakcji ewentualnie umożliwia jej zajście. Katalizator obniża energię aktywacji reakcji. Katalizatory, choć uczestniczą w reakcji, nie zużywają się, po zakończeniu reakcji można je odzyskać.Inhibitory, są to substancje pełniące przeciwną rolę niż katalizatory, obniżają szybkość reakcji lub całkowicie ją blokują.
Podział katalizatorów
a) katalizator heterofazowy- podczas reakcji tworzy odrębną fazę w stosunku do substratów reakcji;b) katalizator homofazowy- podczas reakcji tworzy wspólną fazę z substratami reakcji
Kataliza
Kataliza, jest to zjawisko zwiększania szybkości reakcji w wyniku działania katalizatoraReakcja katalizowana
Reakcja katalizowana, jest to reakcja przebiegająca przy udziale katalizatoraSzybkość reakcji chemicznych
Szybkość reakcji, jest to stosunek ilości przekształconego substratu lub powstającego produktu do czasu, w którym ta ilość powstała.
Jest to cecha charakterystyczna dla danej reakcji, ale można ją zwiększyć lub zmniejszyć.
Szybkość reakcji zależy od:
- rodzaju reakcji i rodzaju substancji reagujących
- stopnia rozdrobnienia substancji reagujących (im większe rozdrobnienie tym większa powierzchnia kontaktu substancji reagujących)
- temperatury
- katalizatorów
- ciśnienia
- stężenia substratów
Podstawowe typy reakcji chemicznych
Podstawowe typy reakcji chemicznych to:- reakcje syntezy
- reakcje analizy (rozkładu)
- reakcje wymiany, które dzielimy na reakcje wymiany pojedynczej i reakcje wymiany podwójnej
- reakcje utleniania- redukcji
Reakcja syntezy
Reakcja syntezy, jest to reakcja łączenia, w której z dwóch lub więcej substratów powstaje zawsze jeden produkt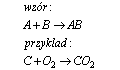
Reakcja analizy (rozkładu)
Reakcja analizy (rozkładu), jest to reakcja, w której z jednego substratu powstaje kilka produktów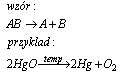
Reakcja wymiany pojedynczej
Reakcja wymiany pojedynczej, jest to reakcja między związkiem chemicznym a pierwiastkiem, Reakcje te zachodzą zgodnie z regułą szeregu napięciowego. W szeregu napięciowym pierwiastki ułożone są w kolejności wzrastających potencjałów. W tych reakcjach, każdy pierwiastek redukuje w roztworze jony pierwiastków o wyższym potencjale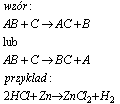
Reakcja wymiany podwójnej
Reakcja wymiany podwójnej, jest to reakcja między dwoma związkami chemicznymi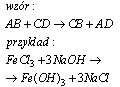
Odwracalność reakcji chemicznych
Odwracalność reakcji oznacza możliwość przekształcania się zarówno substratów w produkty, jak i produktów w substraty w zależności od warunków, w jakich znajduje się układ reagentów. Przeprowadzając reakcję łączenia możemy przeprowadzić reakcję rozkładu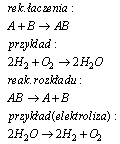
Reakcja praktycznie nieodwracalna
Reakcja praktycznie nieodwracalna, terminem tym określa się reakcję, która w podanych warunkach zachodzi tak, że 100% substratów ulega przemianie w produkty.Stan równowagi chemicznej
Stan równowagi chemicznej, jest to stan, gdy reakcja w jedną i drugą stronę zachodzi z taką samą szybkością. W stanie równowagi stężenia reagentów nie zmieniają się w czasie. Stężenia reagentów w stanie równowagi nie zależą od mechanizmu jej przebiegu, lecz tylko od warunków termodynamicznych (temperatura, ciśnienie). Użycie katalizatora nie ma wpływu na stężenia reagentów w stanie równowagi, ale wpływa na czas ustalenia się tego stanu.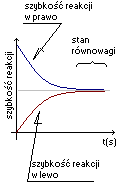
W miarę upływu czasu trwania reakcji, szybkość reakcji w prawo maleje, ponieważ zmniejsza się stężenie substratów. Rośnie szybkość reakcji w lewo, ponieważ wzrasta stężenie produktów.
Stała równowagi chemicznej (Kc)
- jest to wielkość charakterystyczna dla danej reakcji chemicznej i zależy od temperatury, jej wartość określona jest prawem działania mas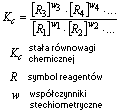
Reguła przekory (reguła Le Chateliera i Brauna)
Jeżeli w układzie stan równowagi zostanie zakłócony, to w układzie rozpocznie się taka przemiana, która zacznie przeciwdziałać zakłóceniom i doprowadzi do ponownego osiągnięcia stanu równowagi. Na przykład:- zwiększenie stężenia substratu lub zmniejszenie stężenia produktu powoduje przesunięcie równowagi w prawo, w kierunku tworzenia produktów;
- ogrzewanie układu, w którym przebiega reakcja egzoenergetyczna, spowoduje przesunięcie równowagi w lewo, w kierunku tworzenia substratów, dla reakcji endoenergetycznych przesunięcie równowagi jest w prawo;
-wzrost ciśnienia powoduje przesunięcie równowagi w prawo, gdy objętość produktów reakcji przebiegającej w fazie gazowej jest mniejsza niż objętość substratów.
Obecność katalizatora lub inhibitora nie ma wpływu na wartość stałej równowagi reakcji.
Prawo Hessa
Efekt cieplny reakcji nie zależy od drogi przemiany pod warunkiem, że wszystkie procesy są izobaryczne lub izochoryczne, a jedynie od stanu początkowego i końcowego.Efekt cieplny reakcji można obliczyć:
a) z sumy efektów cieplnych wszystkich stanów przejściowych
b) na podstawie entalpii tworzenia się związku (różnica sumy entalpii tworzenia produktów i sumy entalpii tworzenia substratów uwzględnieniem liczby moli)
c) na podstawie entalpii spalania reagentów ( różnica sumy entalpii spalania substratów i sumy entalpii spalania produktów z uwzględnieniem liczby moli)










