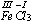Reakcje utleniania- redukcji
Reakcje utleniania- redukcji, są to reakcje, w których następuje przemieszczenie się elektronów (wymiana elektronów) między substancją utleniającą a substancją redukującą, czyli między drobinami reagentów. Proces ten prowadzi do zmiany stopnia utlenienia pierwiastków zawartych w tych reagentach. Procesy utleniania-redukcji nazywane są często procesami redoksowymi - procesami redoks.Odebranie elektronów możliwe jest tylko wówczas, gdy w układzie oprócz atomów, cząsteczek lub jonów oddających elektrony obecne są także atomy, cząsteczki lub jony zdolne do równoczesnego pobrania elektronów; toteż proces utlenienia przebiega zawsze równolegle z procesem redukcji i odwrotnie, redukcji towarzyszy utlenienie.
Utleniacze i reduktory
Utleniacz, to pierwiastek lub związek chemiczny, który w reakcji utleniania- redukcji przyjmuje elektrony (jest akceptorem). Proces przyjmowania elektronów często określa się jako elektronacja. Utleniacz w reakcji zmniejsza swój stopień utlenienia i jednocześnie powoduje jego wzrost w pozostałych produktach reakcji.Utleniacze, utleniając inne substancje, same ulegają redukcji. Do utleniaczy należą pierwiastki najbardziej elektroujemne ( fluor, chlor, brom, tlen) Na przykład fluorowce mają na ostatniej powłoce 7 elektronów, łatwo przyłączają jeden elektron. Tworzy się trwała ośmioelektronowa powłoka zewnętrzna (oktet).
Wśród związków chemicznymi utleniaczami są te, w których występują pierwiastki na najwyższych stopniach utlenienia np. nadmanganian potasu (KMnO
Reduktor
Reduktor, pierwiastek lub związek chemiczny, który w reakcji utlenienia- redukcji dostarcza elektrony (jest donorem). Proces oddawania elektronów określa się jako dezelekronacja. Reduktor w reakcji zwiększa swój stopień utlenienia i jednocześnie powoduje jego zmniejszenie w pozostałych produktach reakcji.Reduktory w procesie redukcji same ulegają utlenieniu. Reduktorami są przede wszystkim pierwiastki najbardziej elektrododatnie, np. metale I grupy układu okresowego (np.sód, potas) a także wodór i węgiel, proste aniony
Ze związków chemicznych do reduktorów zaliczamy te, które posiadają atomy metali lub niemetali na niższym stopniu utlenienia, np. chlorek żelaza(II) FeCl
Równanie połówkowe
Równanie połówkowe, jest to umowny zapis procesu utleniania (dezelektronacji) lub procesu redukcji (elektronacji) z uwzględnieniem liczby elektronów. W zapisie równania połówkowego elektrony oznacza się symbolem e-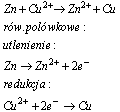
Stopień utlenienia
Stopień utlenienia, jest to liczba ładunków elementarnych, które posiadałby dany atom, gdyby wszystkie wiązania w danej substancji były jonowe. Stopień utlenienia oblicza się jako suma wszystkich elektronów przekazanych i przyjętych przez wybrany atom w ramach danej cząsteczki.Reguły obliczania stopnia utlenienia:
a) stopień utlenienia pierwiastków w stanie wolnym wynosi zero, niezależnie od tego, czy substancja występuje w postaci pojedynczych atomów, czy w postaci cząsteczek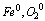
b) stopień utlenienia wodoru w związkach wynosi (+I), z wyjątkiem wodorków metali grupy 1 i 2, dla których przyjmuje wartość (-I)
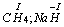
c) tlen w większości związków przyjmuje stopień utlenienia (-II) z wyjątkiem fluorku tlenu
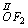
oraz nadtlenków
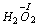
i ponadtlenków
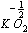
d) litowce w związkach chemicznych mają zawsze stopień utlenienia (+I)
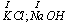
e) berylowce w związkach chemicznych mają zawsze stopień utlenienia (+II)
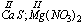
f) suma stopni utlenienia wszystkich atomów w obojętnej cząsteczce jest równa zero
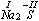
g) stopień utlenienia pierwiastka w jonie prostym jest równy ładunkowi tego jonu
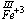
h) suma stopni utlenienia wszystkich atomów wchodzących w skład jonu złożonego jest równa ładunkowi tego jonu
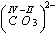
i) stopień utlenienia niemetalu w reszcie kwasowej jest taki sam jak stopień utlenienia tego metalu w danym kwasie