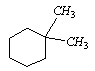Węglowodory nasycone: alkany
Alkany (węglowodory nasycone)
Alkany (węglowodory nasycone) to związki, w których atomy węgla znajdujące się w cząsteczce są połączone tylko wiązaniami pojedynczymi. Najprostszym węglowodorem jest metan: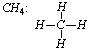
Budowa przestrzenna cząsteczki metanu ma kształt tetraedru (czworościanu foremnego). W narożnikach znajdują atomy wodoru, a w centrum atom węgla
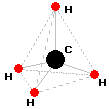
Atom węgla, który połączony jest z czterema innymi atomami wiązaniami pojedynczymi nazywa się tetraedrycznym atomem węgla.
Szereg homologiczny alkanów
Szereg homologiczny tworzą związki chemiczne z tej samej grupy klasyfikacyjnej, które różnią się między sobą o stała grupę atamowó. Dla alkanów jest to grupa:lub jej wielokrotność.
Szereg homologiczny alkanów, to grupa kolejnych związków węgla i wodoru, która można utworzyć dodając do cząsteczki metanu lub poprzedzającego alkanu jeden atom węgla i dwa atomy wodoru.
Wzorem ogólnym n-alkanów jest wzór:
a wzór sumaryczny będący wzorem ogólnym wszystkich alkanów to:
Nazwy i wzory wybranych n- alkanów
Metan
Etan
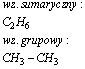
Propan
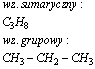
Butan
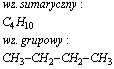
Pentan
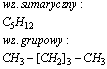
Heksan
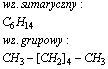
Heptan
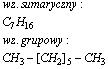
Oktan
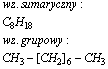
Nonan
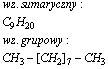
Dekan
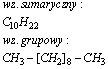
Undekan
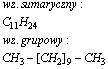
Dodekan
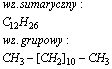
Tridekan
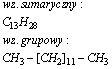
Tetradekan
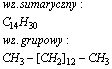
Pentadekan
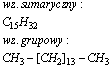
Ejkozan
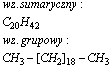
Triakontan
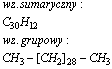
Otrzymywanie alkanów
Węglowodory nasycone otrzymuje się-na skalę przemysłową alkany otrzymuje się z ropy naftowej
-poprzez syntezę (łączenie) pierwiastków w wysokich temperaturach i ciśnieniu przy obecności katalizatorów, na przykład otrzymywanie metanu
-z gazu syntezowego (tlenek węgla(II) i wodór)
Właściwości fizyczne alkanów
W warunkach normalnych pierwsze cztery alkany (metan, etan, propan, butan) z szeregu homologicznego są gazami. Alkany zawierające od pięciu do piętnastu atomów węgla są cieczami, pozostałe to ciała stałe. Alkanom wraz ze wzrostem długości łańcucha węglowego rośnie gęśtość oraz temperatura wrzenia.Alkany nie rozpuszczają się w rozpuszczalnikach polarnych (np. woda), natomiast bardzo dobrze rozpuszczają się w rozpuszczalnikach niepolarnych (np. benzyna).
Spalanie alkanów
Węglowodory nasycone mają zastosowanie jako surowce energetyczne (np. metan, propan, butan), ponieważ w wyniku ich spalania wydziela się duża ilość energii.Przy całkowitym spalaniu na przykład metanu produktami reakcji jest dwutlenek węgla oraz para wodna
Gdy dostęp tlenu będzie ograniczony, to ten sam proces spalania metanu będzie przebiegać z wydzieleniem tlenku węgla i pary wodnej lub węgla i pary wodnej:
Reakcja spalania jest reakcją wspólną dla wszystkich alkanów. Jej zapoczątkowanie wymaga dostarczenia z zewnątrz energii, na przykład przez ogrzanie do wysokiej temperatury. Proces spalania jest najszybszy dla alkanów występujących w fazie gazowej.
Właściwości chemiczne alkanów
Alkany są związkami o niskiej reaktywności chemicznej. Jest to konsekwencją bardzo dużej trwałości wiązań pojedynczych pomiędzy atomami C-C oraz C-H. Wiązania te są prawie niespolaryzowane, co wynika ze zbliżonej elektroujemności węgla i wodoru.Alkany reagują z fluorowcami: fluorem, chlorem i bromem. Nie reagują z jodem. Zainicjowanie tych reakcji wymaga dostarczenia z zewnątrz energii, na przykład przez ogrzanie lub naświetlanie promieniami nadfioletowymi.
Ogólnie reakcję metanu z fluorowcem można zapisać według schematu:
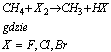
Jest to przykład reakcji podstawienia (reakcja substytucji). Reakcja ta jest charakterystyczną reakcją dla węglowodorów nasyconych. Polega ona na tym, że atomy w związku organicznym zastępowane są (podstawiane) atomami innych pierwiastków.
Halogenoalkany (fluorowcoalkany)
Halogenoalkany (fluorowcoalkany) to pochodne alkanów, które powstają w reakcjach substytucji alkanów. W związkach tych został zastąpiony jeden lub kilka atomów wodoru przez atom fluorowca (za wyjątkiem jodu).Aktywność halogenoalkanów wykorzystuje się do otrzymywania alkanów w reakcji syntezy Wurtza. Tą metoda otrzymuje się alkany o dłuższych łańcuchach atomów węgla, na przykąłd z chlorometanu otrzymamy etan:
Izomeria alkanów i halogenoalkanów
Większość alkanów (za wyjątkiem metanu, etanu i propanu) jest izomerami, to znaczy związkami, o takim samym wzorze sumarycznym, ale o innej budowie cząsteczek.Na przykład butan tworzy dwa izomery, które różnią się budową łańcucha szkieletowego:
n-butan
izobutan (metylopropan)
Dla obu związków wzór sumaryczny to
Przykładem izomerii dla halogenoalkanów jest izomeriia podstawienia (położenia), czyli izomery różnią się położeniem podstawników jest:
1-chloropropan
oraz
2- chloropropan
Dla obu związków wzór sumaryczny to
Cykloalkany
Cykloalkany to węglowodory nasycone o budowie pierścieniowej (cyklicznej). Najmniejszy pierścień, jaki można utworzyć z atomów węgla składa się z trzech atomów tego pierwiastka. Najmniejszy cykloalkan, to cyklopropan.Najprostsze cykloalkany:
-cyklopropan
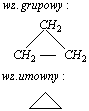
-cyklobutan
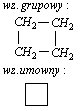
-cyklopentan
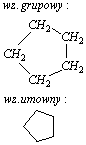
-cykloheksan
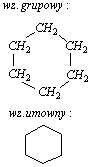
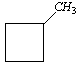
Cykloalkany mogą mieć doczepione do pierścienia grupy alkilowe. Takie cząsteczki są analogia do alkanów o rozgałęzionych łańcuchach, na przykład:
-metylocyklobutan
-1,1-dimetylocykloheksan