Wiązania chemiczne
Teoria wiązań (Lewisa i Kossela)
Reguła dubletu i oktetu
Atomy tworzące związek chemiczny dążą do zapewnienia sobie stabilności poprzez osiągnięcie konfiguracji walencyjnej najbliższego gazu szlachetnego. Może to być walencyjna konfiguracja dubletu (dwa elektrony walencyjne) lub oktetu (8 elektronów walencyjnych)Wiązanie chemiczne
Wiązanie chemiczne, jest to efekt różnego rodzaju oddziaływań pomiędzy wiążącymi się atomami. Atomy łączące się ze sobą w cząsteczki dążą do uzyskania konfiguracji walencyjnej helowca, który w układzie okresowym znajduje się najbliżej nich.Wiążące się atomy mogą uzyskać konfigurację helowca trzema sposobami:
- przez przeniesienie elektronów, doprowadzi to do utworzenia wiązania jonowego;
- przez uwspólnienie elektronów, doprowadzi to dotworzenia wiązania kowalencyjnego (atomowego), kowalencyjnego spolaryzowanego (atomowego spolaryzowanego), lub koordynacyjnego;
- przez delokalizację elektronów, doprowadzi to do utworzenia wiązania metalicznego
Elektroujemność pierwiastka
Elektroujemność pierwiastka, to cecha pierwiastka określająca jego zdolność do przyciągania lub oddawania elektronów. Pierwiastki elektrododatnie oddają elektrony, a pierwiastki elektroujemne przyjmują elektrony.Elektroujemność pierwiastków w poszczególnych grupach układu okresowego maleje wraz ze wzrostem liczby masowej, natomiast w kolejnych okresach rośnie od lewej strony do prawej.
Pierwiastki najbardziej elektroujemne mają położenie w prawym górnym rogu układu okresowego. Pierwiastki te mają niedużą ilość powłok elektronowych, co oznacza silne przyciąganie przez jądro atomowe, chęć uzupełnienia niewielkiej ilości elektronów do uzyskania oktetu elektronowego.Pierwiastki o najmniejszej elektroujemności położone są w lewym dolnym rogu układu okresowego. Posiadają większą ilość powłok elektronowych, a to oznacza słabsze przyciąganie elektronów przez jądro atomowe. Pierwiastek taki łatwiej odda elektron walencyjny, aby uzyskać konfigurację walencyjną najbliższego mu helowca.
Wiązanie kowalencyjne (atomowe)
Wiązanie kowalencyjne, jest to wiązanie atomów w cząsteczki, które powstaje poprzez uwspólnienie jednej lub kilku par elektronów, atomy tworzące to wiązanie zachowują się tak, jakby miały konfigurację gazu szlachetnego. Wiązanie to występuje wtedy, gdy różnica elektroujemności wiążących się atomów spełnia poniższy warunek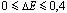
Wiązanie kowalencyjne przedstawione
a) wzorem elektronowym kropkowym
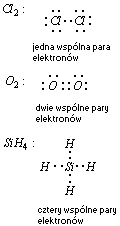
b) wzorem elektronowym kreskowym
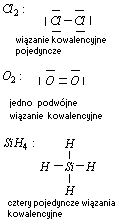
Wiązanie kowalencyjne spolaryzowane
Wiązanie kowalencyjne spolaryzowane powstaje w cząsteczkach, w których różnica elektroujemności miedzy łączącymi się atomami wynosi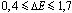
W wiązaniu tym jest duża różnica elektroujemności pomiędzy atomami. Następuje przesunięcie wspólnej pary elektronowej w stronę pierwiastka o większej elektroujemności. Cząsteczka jako całość jest elektrycznie obojętna, ale wewnątrz niej następuje nierównomierny rozkład ładunku. Przy atomie o większej elektroujemności gromadzi się ładunek ujemny, a przy atomie o mniejszej elektroujemności ładunek dodatni. Tworzy się cząsteczka elektrycznie dwubiegunowa- dipol.
Miarą przesunięcia ładunku elektrycznego jest moment dipolowy. Jego brak świadczy o symetrycznej budowie cząsteczki. Jeżeli jest różny od zera, to cząsteczka ma budowę nieliniową, na przykład cząsteczka wody
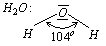
W cząsteczce wody tworzą się dwie wspólne pary elektronowe, które są wiązaniem wodór- tlen. Na jednym końcu, przy atomie tlenu, powstaje biegun ujemny, na drugim, przy atomach wodoru powstaje biegun dodatni. Niesymetryczny rozkład ładunku powoduje polarność cząsteczki.
Wiązanie jonowe
Wiązanie jonowe powstaje, gdy różnica elektroujemności pomiędzy atomami tworzącymi wiązanie spełnia warunek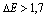
Wiązanie jonowe polega na oddziaływaniu elektrostatycznym pomiędzy różnoimiennymi jonami, które powstają w wyniku przeniesienia elektronów z atomu mniej elektroujemnego do atomu bardziej elektroujemnego, co jest spowodowane dążeniem atomów do uzyskania trwałej konfiguracji elektronowej gazu szlachetnego.
Przykładem jest cząsteczka powstała z magnezu i chloru (MgCl2)
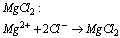
Przegrupowanie elektronów pomiędzy atomami magnezu i chloru możemy przedstawić poniższym modelem
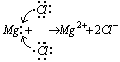
Wiązanie wodorowe
Wiązanie wodorowe, jest to słabe oddziaływanie elektrostatyczne występujące miedzy atomem wodoru a wolna parą elektronową pierwiastka o dużej elektroujemności (tlen, fluor, azot). Atom wodoru ma w tym przypadku charakter ładunku dodatniego.Wiązania wodorowe występują w wodzie, amoniaku, kwasach nukleinowych, alkoholach. Wiązanie to prowadzi do łączenia się cząsteczek w większe zespoły (asocjacja), powodując zmianę właściwości fizycznych, na przykład: rozpuszczalność, gęstość, temperatura wrzenia. Wiązanie wodorowe oznacza się wielokropkiem(…).
Przykład wiązania wodorowego między cząsteczkami wody (asocjacja cząsteczek wody)
Wiązania koordynacyjne
Wiązania koordynacyjne (donorowo- akceptorowe), to rodzaj wiązania kowalencyjnego, tworzy się ono między atomami niemetali. Warunkiem jego powstania jest to, że wszystkie elektrony wiązania pochodzą tylko od jednego z atomów (donora), drugi atom tylko je przyjmuje- jest akceptorem.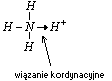
Wiązania metaliczne
Wiązania metaliczne, to wiązania występujące między atomami metalu, są wiązaniami kowalencyjnymi, ale różną się w stosunku do analogicznych wiązań między niemetalami:- ulegają łatwiejszej polaryzacji pod wpływem np. zewnętrznego pola elektrycznego, ponieważ ogólnie w metalach elektrony walencyjne są słabiej związane z jądrami atomów niż w niemetalach
- ze względu na występowanie w metalach dużej liczby walencyjnych orbitali (d) zachodzi zjawisko ich nakładania
Właściwości związków a rodzaje wiązań
Właściwości związków zawierających wiązania kowalencyjne:- w stanie stałym tworzą kryształy cząsteczkowe np. S8, SiH4 lub kryształy kowalencyjne (Si, Ge)
- nie przewodzą prądu elektrycznego (wyjątkiem jest grafit)
- rozpuszczają się w rozpuszczalnikach niepolarnych (np. w benzynie)
- nie dysocjują
- reagują powoli (przyczyna są mocne wiązania kowalencyjne)
Właściwości związków zawierających wiązania kowalencyjne spolaryzowane:
- w stanie stałym tworzą kryształy kowalencyjne
- rozpuszczają się w rozpuszczalnikach polarnych (np. w wodzie)
- niektóre dysocjują (np. HCl)
Właściwości związków zawierających wiązania jonowe
- w stanie stałym tworzą jonowe sieci krystaliczne, w których na przemian rozmieszczone są jony dodatnie i ujemne
- cechuje je wysoka temperatura topnienia i wrzenia
- kryształy jonowe nie przewodzą prądu elektrycznego
- rozpuszczają się w rozpuszczalnikach polarnych (np. w wodzie)
- podczas rozpuszczania w wodzie dysocjują - rozpadają się na jony, taki roztwór dobrze przewodzi prąd
- reakcje między jonami w roztworach wodnych zachodzą bardzo szybko
Substancje jonowe
Substancja jonowa (związek jonowy), jest to substancja, która zawiera wiązanie jonowe, jest zbudowana z jonów: kationów i anionów. Przykładem substancji jonowych są sole, wodorotlenki i tlenki metali. W solach kwasów tlenowych wiązanie jonowe łączy metal z resztą kwasową. W wodorotlenkach wiązanie jonowe jest miedzy kationem metalu, a jednoujemnym anionem OH-. Tlenki metali to kation metalu i dwuujemny anion O2-.Jon
Jon, jest to pojęcie określające drobinę jednojądrową lub wielojądrową, drobina ta posiada ładunek elektryczny.Substancje jonowe różnią się od substancji kowalencyjnych poniższymi cechami:
- budowa sieci krystalicznej, tworzy je jonowa siec krystaliczna, na przykład jonowa sieć krystaliczna chlorku sodu (NaCl)
- przewodnictwem elektrycznym, w stanie stałym substancje jonowe nie przewodzą prądu
- podatnością na dysocjację jonową, substancje jonowe łatwo ulegają dysocjacji, ich wodne roztwory przewodzą prąd elektryczny
- rozpuszczalnością, substancje jonowe łatwiej się rozpuszczają w wodzie niż w rozpuszczalnikach polarnych
- szybkością reakcji, reakcje z udziałem związków jonowych w ich roztworach zachodzą natychmiastowo
- temperaturą topnienia i wrzenia, substancje jonowe mają wysoka temperaturę topnienia i wrzenia
Substancje kowalencyjne
Właściwości substancji kowalencyjnych najczęściej są przeciwieństwem właściwości substancji jonowych:- budowa sieci krystalicznej substancji kowalencyjnych w stanie stałym może być utworzona z dwóch rodzajów kryształów: cząsteczkowych (molekularnych) i kowalencyjnych (np.diament)
- przewodnictwo elektryczne, substancje kowalencyjne w stanie stałym oraz ciekłym nie przewodzą prądu elektrycznego (wyjątkiem jest grafit)
- podatność na dysocjację jonową, większość substancji kowalencyjnych nie ulega dysocjacji jonowej, wyjątkiem są wiązania silni spolaryzowane (wodorki fluorowców, kwasy tlenowe)
- rozpuszczalność, substancje kowalencyjne z wiązaniem niespolaryzowanym lub słabo spolaryzowanym rozpuszczają się w rozpuszczalnikach niepolarnych (np. benzyna), prawie w ogóle nie rozpuszczają się w rozpuszczalnikach polarnych (np. woda)
- szybkość reakcji, substancje kowalencyjne na ogół reagują bardzo wolno, ponieważ warunkiem zajścia reakcji często jest rozerwanie wiązania
- temperatura topnienia i wrzenia, substancje kowalencyjne tworzące kryształy cząsteczkowe maja niskie temperatury topnienia i wrzenia, natomiast kryształy kowalencyjne (np. diament) są bardzo trwałe i topnieją w wysokich temperaturach.
Kierunkowość wiązań kowalencyjnych
Wiązania kowalencyjne mają charakter kierunkowy. Kierunek wiązania wyznaczony jest przez prostą łącząca jądra sąsiadujących atomów.O geometrii drobiny decyduje wzajemne odpychanie:
- wiążących par elektronów, które są wspólne dla dwóch sąsiednich jąder
- wolnych par elektronów, które są elektronami walencyjnymi i nie biorących udziału w tworzeniu wiązania
Rodzaje elektronów wiążących
Rozróżnia się dwa rodzaje elektronów wiążących, które tworzą pary typua) sigma, oznaczone symbolem σ
b) pi, oznaczone symbolem π
Typy elektronów wiążących różnią się energią (elektrony typu sigma mają niższą energię) oraz kształtem przestrzeni najczęstszego ich przebywania (chmura elektronowa)
Wiązanie pojedyncze jest utworzone z pary typu sigma, wiązanie wielokrotne składa się z jednej pary sigma oraz jednej (dla wiązania podwójnego) lub dwóch (dla wiązania potrójnego) par typu pi.
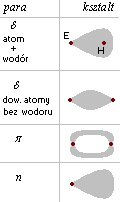
Chmury elektronowe
Chmura elektronów typu sigma ma kształt spadochronu, gdy tworzy ja atom wodoru z innym atomem. W pozostałych przypadkach ma kształt wrzeciona.Chmura elektronów typu pi znajduje się poza prostą łączącą jądra atomów, nie ma ona wpływu na kat miedzy wiązaniami.
Chmura elektronów typu n, jest utworzona przez wolne pary elektronów, ma kształt spadochronu.