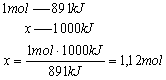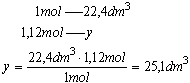Na podstawie równania termochemicznego:
CH4(g)+2O2(g)Na podstawie równania termochemicznego:
CH4(g)+2O2(g)->CO2(g)+2H2O(c); (delta)H=-891kJ
obliczyć, jaką objętość metanu (warunki normalne) należy spalić, aby uzyskać 1000kJ energii sposobem termicznym?
Rozwiązanie wybranego zadania z chemii
Wskazówka: Z proporcji obliczymy liczbę moli potrzebną do otrzymania 1000kJ
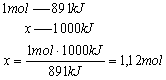
Wiemy, że 1 mol gazu w warunkach normalnych zajmuje 22,4dm3. Stąd obliczona liczba moli zajmuje objętość:
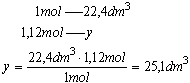
CH4(g)+2O2(g)->CO2(g)+2H2O(c); (delta)H=-891kJ
obliczyć, jaką objętość metanu (warunki normalne) należy spalić, aby uzyskać 1000kJ energii sposobem termicznym?